Enzimele sunt esențiale pentru buna funcționare a tuturor organismelor vii de pe Pământ. Aceștia participă la majoritatea, dacă nu la toate, schimbările chimice în natură, adică la milioane de reacții atât în lumea plantelor, cât și în lumea animală. Merită să aflați ce sunt enzimele, cum funcționează și care este semnificația lor pentru medicina modernă.
Cuprins
- Enzime: Structură
- Reglarea activității enzimatice
- Enzime: Rol
- Enzime: Nomenclatură
- Enzime și medicamente
- Boli rezultate din enzime disfuncționale
- Enzime: se utilizează în diagnosticare
- Enzime și tratament
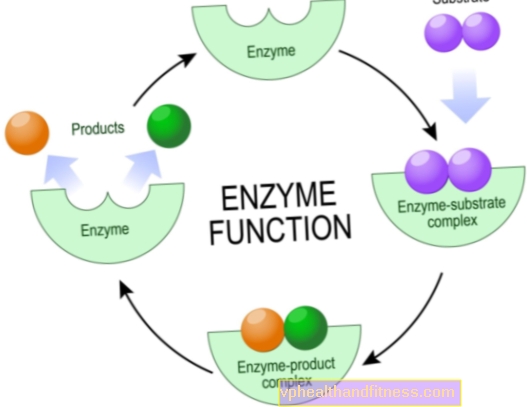
Enzimele sunt molecule de proteine care accelerează sau chiar permit diverse reacții chimice să aibă loc în organismele vii, inclusiv în corpul uman.
Din punct de vedere chimic, aceștia sunt catalizatori, adică particule care intensifică reacția, dar nu se uzează în timpul reacției. Această creștere a eficienței transformărilor chimice este adesea enormă, catalizatorii naturali pot scurta timpul de reacție de la câțiva ani la câteva secunde.
Enzimele se găsesc în toate zonele corpului: în celule, în spațiul extracelular, în țesuturi, în organe și în lumina lor, catalizatorii pe care îi produce un anumit țesut determină proprietățile sale specifice și rolul pe care îl joacă în organism.
Majoritatea enzimelor sunt foarte specifice, ceea ce înseamnă că fiecare dintre ele este responsabilă pentru un singur tip de reacție chimică în care sunt implicate particule specifice - substraturile și numai ele pot interacționa cu o anumită enzimă.
Activitatea catalizatorilor naturali depinde de mulți factori: mediul de reacție, de exemplu temperatura, pH-ul, prezența anumitor ioni, activatori - acestea sporesc acțiunea enzimelor și inhibitorilor care contracarează această activitate.
Enzime: Structură
După cum sa menționat, majoritatea enzimelor sunt proteine, au o structură foarte diversă: de la câteva zeci de aminoacizi la câteva mii dispuse într-o structură spațială diversă.
Este forma formării lor (așa-numita structură cuaternară) și faptul că majoritatea enzimelor sunt mult mai mari decât reactanții reacțiilor lor este în mare parte responsabil pentru activitatea lor.
Acest lucru se datorează faptului că doar o anumită regiune din structura enzimelor este așa-numitul sit activ, adică fragmentul responsabil de efectuarea reacției.
Sarcina restului de fragmente ale moleculei este de a atașa un substrat specific, mai rar alți compuși care influențează activitatea enzimei.
Merită să știm că structura catalizatorului este proiectată astfel încât substratul de îmbinare să se potrivească în mod ideal în termeni de „cheie de blocare”.
La fel ca toate proteinele, enzimele sunt produse în ribozomi din materialul genetic care este strâns ambalat în nucleu - ADN, creând astfel o așa-numită structură primară.
Apoi se supune de mai multe ori - schimbându-și forma, adăugând uneori zaharuri, ioni metalici sau reziduuri grase.
Rezultatul tuturor acestor procese este formarea unei structuri cuaternare active, adică o formă complet activă biologic.
În multe cazuri, mai multe particule de enzime se combină pentru a efectua o serie de reacții chimice și, astfel, accelera procesul.
Se întâmplă ca în mai multe țesuturi să existe enzime care catalizează aceeași reacție, dar ele nu sunt similare structural între ele, le numim izoenzime.
Numele izoenzimelor sunt aceleași, în ciuda diferenței de localizare și structură, dar aceste diferențe au o aplicație practică. Astfel, este posibil să se determine în testele de laborator doar acele fracțiuni enzimatice care provin dintr-un anumit organ.
Mecanismele de acțiune ale enzimelor sunt diverse, dar din punct de vedere chimic, sarcina lor este întotdeauna de a reduce energia de activare a reacției. Aceasta este cantitatea de energie pe care trebuie să o aibă substraturile pentru ca procesul să aibă loc.
Acest efect poate fi atins prin crearea unui mediu adecvat pentru a efectua reacția, folosind o cale chimică diferită pentru a obține aceleași produse sau aranjarea spațială adecvată a substraturilor.
Fiecare dintre aceste mecanisme poate fi utilizat de enzime.
Reglarea activității enzimatice
Acțiunea enzimelor depinde de parametrii de mediu: temperatură, pH și altele. Fiecare dintre catalizatorii naturali are propriile performanțe optime în anumite condiții, care pot fi în mare măsură diferite în funcție de toleranța sa la condițiile de mediu.
În cazul temperaturii, majoritatea reacțiilor enzimatice se desfășoară mai repede la temperaturi mai ridicate, dar la o anumită temperatură eficiența reacției scade brusc, care este cauzată de deteriorarea termică a enzimei (denaturare).
În ceea ce privește structura lor, hormonii pot fi împărțiți în două grupe:
- simple - acestea sunt doar particule de proteine
- complex - care necesită atașarea unui grup nonproteic - un cofactor la activitatea lor
Acestea din urmă joacă un rol cheie în activitatea adecvată și reglarea enzimelor.
La rândul lor, cofactorii pot fi împărțiți în două grupe: cele necesare funcționării enzimei, puternic asociate cu aceasta - acestea sunt așa-numitele grupări protetice, pot fi metale, molecule organice, cum ar fi, de exemplu, hemul.
Al doilea grup este coenzimele, ele sunt de obicei responsabile pentru transferul de substraturi sau electroni, iar legarea lor de enzimă este slabă, acest grup cuprinde, de exemplu, acidul folic, coenzima A. Merită să știm că multe vitamine acționează ca cofactori.
Inhibitorii îndeplinesc o sarcină complet diferită, sunt particule care inhibă activitatea enzimatică prin legarea de enzimă.
Există mai multe tipuri de inhibitori:
- ireversibile - provoacă inactivarea permanentă a moleculei și reacția poate avea loc numai după producerea unei noi enzime
- competitiv - în acest caz, inhibitorul are o structură similară cu substratul, deci concurează pentru locul activ. Dacă este atașat un inhibitor, reacția eșuează atâta timp cât substratul este normal
- necompetitiv - astfel de inhibitori leagă enzima într-un alt loc decât se atașează substratul, astfel încât se poate atașa la enzimă, dar reacția nu are loc
La o concentrație mult mai mare a substratului decât inhibitorul, efectul inhibitorului competitiv este depășit deoarece depășește „concurența” pentru situl activ, în cazul necompetitiv, efectul său nu poate fi depășit prin creșterea concentrației substratului.
În plus față de reglarea activatorului și a sistemelor de inhibitori, există multe alte metode de control al activității enzimei.
Acestea se referă la controlul producției celulei la nivelul formării proteinelor, precum și la reglarea așa-numitei prelucrări post-translaționale, adică modificări ale structurii unei molecule de proteine care apar imediat după sinteza acesteia în ribozom. Aceste modificări sunt, de exemplu, scurtarea lanțului polipeptidic.
Alte metode de reglare se referă la segregarea și plasarea enzimelor în zone adecvate: celulare și în organite specifice sau în compartimentul extracelular.
Există un alt mecanism de reglementare important - feedback-ul negativ - este sistemul principal de control din sistemul endocrin. Funcționează pe principiul inhibiției.
Aceasta înseamnă că, dacă o enzimă produce prea mult dintr-un anumit hormon, se leagă de aceasta provocând o inhibare a activității și o reducere a sintezei, astfel încât produsul de reacție în sine inhibă producția sa.
Enzime: Rol
Fiecare țesut al corpului uman produce un set specific de enzime, care definește rolul acestor celule în funcționarea corpului. Ce sunt aceste enzime este definit de codul genetic și ce regiuni sunt active într-o anumită celulă.
Mii de reacții chimice au loc în corpul uman în orice moment, fiecare dintre acestea necesitând o anumită enzimă, deci ar fi dificil să enumerăm toate aceste particule prezente în corpul nostru.
Cu toate acestea, merită să cunoașteți câteva dintre cele mai caracteristice:
- Enzime digestive - produse de țesuturile sistemului digestiv, descompun alimentele în compuși simpli, deoarece numai aceștia pot fi absorbiți în sânge. Sunt enzime extracelulare, deci își îndeplinesc sarcina principală în afara celulelor în care sunt produse. Unele dintre aceste enzime sunt formate într-o formă inactivă, așa-numitele proenzime sau zimogene și sunt activate în tractul gastro-intestinal. Enzimele digestive includ, de exemplu, amilaza, lipaza, tripsina.
- Miozina este o enzimă care se găsește în mușchi, descompune moleculele ATP care sunt purtătoare de energie, datorită cărora determină contractarea fibrelor musculare.
- Peroxidazele sunt enzime oxidante și catalaze, adică enzime reducătoare
- Acetilcolinesteraza este o enzimă care descompune acetilcolina, unul dintre mesagerii din sistemul nervos
- Monoamin oxidaza este enzima cea mai abundentă în ficat și este responsabilă pentru descompunerea adrenalinei, norepinefrinei și a unor medicamente
- Citochom oxidaza, o enzimă intracelulară foarte importantă responsabilă de modificările energetice
- Lizozima, o substanță prezentă de exemplu în lacrimi sau salivă care îndeplinește funcții de protecție, distruge agenții patogeni
- Alcoolul dehidrogenază, o enzimă din ficat responsabilă de descompunerea etanolului
- Fosfataza alcalină, participă la construirea oaselor de către osteoblaste
Enzime: Nomenclatură
Numele enzimelor sunt adesea destul de complicate, deoarece derivă din numele reacției pe care o desfășoară și substratul implicat în reacție, de exemplu 5-hidroxitriptofan decarboxilaza.
De obicei, sufixul "-aza" este adăugat la numele general al reacției, iar a doua parte a numelui enzimei este formată din numele compusului care suferă această reacție.
Se întâmplă ca numele să fie unic, apoi provine dintr-un substrat, de exemplu lactază (enzimă care descompune lactoza).
Mai rar, numele enzimelor derivă dintr-un proces general care are loc cu participarea lor, de exemplu ADN girază, adică enzima responsabilă de rotirea firelor de ADN.
Unele enzime au în cele din urmă nume comune sau nume date de descoperitorul lor, cum ar fi pepsina (care descompune proteinele din tractul digestiv) sau lizozima (o enzimă bactericidă conținută în lacrimi).
Există, de asemenea, un grup mic de enzime de restricție care sunt responsabile pentru tăierea catenelor de ADN, în acest caz denumirea provine de la microorganismul din care a fost izolată enzima.
Uniunea Internațională de Biochimie și Biologie Moleculară a introdus regulile de numire a enzimelor și le-a împărțit în mai multe clase pentru a standardiza nomenclatura.
Nu a înlocuit denumirile descrise mai devreme, este mai degrabă un supliment la acestea, utilizat în primul rând de oamenii de știință.
Conform regulilor Uniunii Europene, fiecare enzimă este descrisă printr-o succesiune de caractere: EC x.xx.xx.xx - unde prima cifră reprezintă clasa, subclasele și subclasele ulterioare și, în final, numărul enzimei. Clasele de enzime menționate sunt:
• 1 - oxidoreductaze: catalizează reacțiile de oxidare și reducere
• 2 - transferaze: grupuri funcționale de transfer (de exemplu fosfat)
• 3 - hidrolaze: corespund hidrolizei (descompunerii) legăturilor
• 4 - lyase: rup legăturile într-un mecanism diferit de cel al hidrolizei
• 5 - izomerasele: sunt responsabile de modificările spațiale ale moleculelor
• 6 - ligazele: leagă moleculele cu legături covalente
Enzime și medicamente
Importanța enzimelor pentru sănătatea umană este enormă. Funcționarea corectă a acestora permite o viață sănătoasă și, datorită dezvoltării dispozitivelor analitice, am învățat să diagnosticăm diferite boli prin determinarea enzimelor. Mai mult, suntem capabili să tratăm cu succes deficiențele unor enzime și bolile rezultate, dar, din păcate, mai sunt multe de făcut în această chestiune.
Tratamentul cauzelor bolilor metabolice nu este în prezent posibil, deoarece nu suntem în măsură să modificăm în siguranță și în mod eficient materialul genetic pentru a repara genele deteriorate și, astfel, produc enzimele incorecte.
Boli rezultate din enzime disfuncționale
Buna funcționare a corpului nostru depinde în mare măsură de buna funcționare a enzimelor. În multe cazuri, stările de boală afectează cantitatea de enzime, determinând eliberarea excesivă a acestora din celule sau, dimpotrivă, deficitare.Următoarele sunt doar exemple de boli cauzate de funcții enzimatice anormale, există multe altele.
- Blocuri metabolice sau boli metabolice
Blocurile metabolice sau bolile metabolice sunt un grup de boli moștenite cauzate de acumularea de substanțe în celulă din cauza lipsei unei enzime responsabile de metabolismul lor. Substraturile acumulate în timp sunt atât de mari încât devin toxice pentru celule și pentru întregul organism.
Există câteva mii dintre aceste boli, numărul lor reflectă multitudinea de enzime găsite în corpul uman, deoarece bolile metabolice pot afecta majoritatea genelor care codifică enzimele.
Exemple sunt galactozemia sau homocistinuria, care sunt boli rare, manifestate cel mai adesea imediat după naștere sau în primii ani de viață.
- Tumori
Un alt grup de boli în care poate fi implicată defecțiunea enzimei este cancerul. Pe lângă multe alte funcții, enzimele sunt responsabile și de reglarea diviziunii celulare, așa-numitele tirozin kinaze. Dacă aceste enzime eșuează în această zonă, poate apărea diviziune celulară necontrolată și, prin urmare, un proces neoplazic.
- Emfizem
O boală mai puțin frecventă este emfizemul, caz în care elastaza devine hiperactivă. Este o enzimă prezentă în țesutul pulmonar responsabilă de descompunerea proteinei elastinei prezente în plămâni, printre altele.
Dacă este prea activ, echilibrul dintre distrugere și construire este perturbat, apare cicatrici și se dezvoltă emfizem.
Enzime: se utilizează în diagnosticare
Diagnosticul medical modern se bazează pe utilizarea enzimelor în determinările lor. Acest lucru se datorează faptului că stările de boală conduc direct sau indirect la un dezechilibru al enzimelor, determinând creșterea sau scăderea cantității lor în sânge.
Acest lucru poate rezulta nu numai din tulburări de producție, ci și, de exemplu, din eliberarea unei cantități mari de enzime intracelulare în sânge sau urină ca urmare a deteriorării membranei sale celulare.
Exemple de enzime utilizate în testele de laborator sunt:
- Creatin kinaza - o enzimă prezentă în mușchi, de asemenea în mușchiul inimii, creșterea sa multiplă poate indica un atac de cord, miocardită, boli musculare - leziuni, distrofie.
- Lactat dehidrogenază - prezent în toate celulele corpului, în special în creier, plămâni, celule albe din sânge și mușchi. Creșterea sa mare se observă în infarctul miocardic, bolile musculare și hepatice sau cancerul.
- Fosfataza alcalină se găsește mai ales în ficat și oase, aici este eliberată de osteoblaste. Bolile acestor organe pot cauza creșterea acestuia, dar excesul de fosfatază alcalină poate indica, de asemenea, procesul de regenerare a oaselor - după operație sau fractură.
- Fosfataza acidă apare în multe organe - ficat, rinichi, oase, prostată, din punct de vedere diagnostic creșterea sa poate indica boli ale oaselor și prostatei.
- Aspartat aminotransferază și alanină aminotransferază - acestea sunt enzime caracteristice ficatului, care apar aproape exclusiv în hepatocite, sunt utilizate în diagnosticul de screening de bază al bolilor hepatice, iar creșterile lor de mai multe ori în valori determină întotdeauna un diagnostic suplimentar al bolilor hepatice.
- Glutamatul dehidrogenază și gammaglutamiltransferaza - alte enzime hepatice, similar cu cele menționate anterior, sunt importante în diagnosticul bolilor acestui organ și ale tractului biliar.
- Amilaza este o enzimă prezentă în multe organe, dar cea mai mare concentrație se realizează în celulele pancreasului și ale glandelor salivare, diagnosticul său este de cea mai mare importanță în bolile lor.
- Lipaza este o altă enzimă pancreatică, diferă în specificitate de amilază, ceea ce înseamnă că lipaza apare doar în pancreas și abaterile de la normă la determinarea acestei enzime indică o boală pancreatică.
- Colinesteraza este o enzimă care descompune acetilcolina - un transmițător în sistemul nervos, unde este, de asemenea, prezent în cea mai mare cantitate, în diagnosticare este utilizat în otrăvirea cu compuși organofosforici.
- Factori de coagulare și fibrinoliză - sunt substanțe produse de ficat implicate în coagularea sângelui, determinările lor sunt importante nu numai în evaluarea acestui proces, ci și în monitorizarea funcției hepatice.
- Alfa-fetoproteina - o enzimă hepatică, a cărei cantitate crește în bolile acestui organ, inclusiv în cancer.
- Proteina C-reactivă - produsă de ficat, participând la răspunsul imun, cantitatea sa crește în sânge în condiții inflamatorii - infecții, leziuni, boli autoimune.
- Ceruloplasmin - o altă enzimă hepatică, o creștere caracteristică bolii Wilson.
- Piridinolina și deoxipiridinolina sunt markeri ai resorbției (distrugerii) osoase și caracterizează funcția osteoclastelor (celule osteogene).
- Mioglobina - așa cum am menționat mai devreme, acesta este un compus caracteristic mușchilor, astfel încât creșterea acestuia va indica deteriorarea mușchilor scheletici sau cardiaci.
- Troponinele - așa-numiții markeri ai infarctului, sunt enzime care reglează contracția fibrelor musculare, sunt deosebit de abundente în mușchiul inimii. Afectarea acestuia determină eliberarea în sânge a unor cantități mari de troponine, care este utilizată în diagnosticul bolilor de inimă. Cu toate acestea, merită să ne amintim că o creștere a troponinelor poate indica nu numai un atac de cord, ci și insuficiența acestuia, defecte valvulare sau embolie pulmonară.
Toate enzimele enumerate mai sus pot fi clasificate în mai multe grupe:
- Enzime secretorii - limita inferioară a normei este diagnosticarea. Acestea sunt enzime care sunt produse fiziologic de organe, dar în cazul bolilor numărul lor scade, de exemplu, factorii de coagulare
- Enzime indicatoare - creșterea este importantă. Acest grup de enzime apare în număr mare din cauza deteriorării organelor și a scurgerii enzimelor, acestea includ, de exemplu, troponine
- enzime excretoare - acestea sunt enzime produse în mod normal în lumenul diferitelor organe - gură, intestine sau căile urinare. Dacă ieșirea lor este blocată, intră în sânge, de exemplu amilază
Merită să ne amintim că enzimele sunt utilizate în diagnosticul medical în sine. Analizele biochimice sunt efectuate cu utilizarea enzimelor, iar interpretarea adecvată a rezultatelor reacțiilor enzimatice permite furnizarea rezultatului unui test de laborator.
Enzime și tratament
Multe medicamente acționează influențând acțiunea enzimelor, fie prin determinarea acțiunii acestora, fie, dimpotrivă, prin inhibarea lor. Există înlocuitori enzimatici, cum ar fi pancreatina care conține lipază și amilază pentru insuficiența pancreatică.
Pe de altă parte, unele grupuri de medicamente inhibă acțiunea enzimelor, de exemplu, inhibitori ai enzimei de conversie a angiotensinei, utilizați, printre altele, în hipertensiune arterială și insuficiență cardiacă, sau unele antibiotice, de exemplu, amoxicilină, care inhibă enzima transpeptidază bacteriană, care împiedică construirea peretelui celular bacterian și, astfel, inhibă infecţie.
Unele otrăvuri funcționează și prin afectarea enzimelor. Cianura este un inhibitor puternic al citocrom oxidazei, o componentă esențială a lanțului respirator. Blocarea acestuia împiedică celula să obțină energie, ceea ce duce la moartea acesteia.
Pentru buna desfășurare a proceselor de viață ale celulelor, este necesară prezența multor substanțe chimice, rămânând în proporții stricte între ele și între care apar în mod constant reacții chimice.
Această sarcină este realizată de enzime care funcționează corespunzător, care sunt necesare pentru ca aproape orice reacție chimică să aibă loc cu viteza și eficiența necesare pentru buna funcționare a corpului uman.
Acțiunea enzimelor accelerează aceste procese de multe ori, adesea chiar de sute de ori, ceea ce este important, enzimele în sine nu se uzează în timpul reacțiilor care au loc.
Lipsa catalizatorilor sau funcționarea necorespunzătoare a acestora poate duce la apariția multor boli. Pe de altă parte, modificarea abilă a activității lor vă permite să tratați cu succes multe afecțiuni.
Enzimologia (știința enzimelor) este extrem de extinsă, iar dezvoltarea acesteia poate aduce nu numai progres științific, ci și contribuie activ la dezvoltarea medicinei în domeniul nu numai al tratamentului, ci și al diagnosticului.
Despre autor




















-przyczyny-objawy-leczenie.jpg)